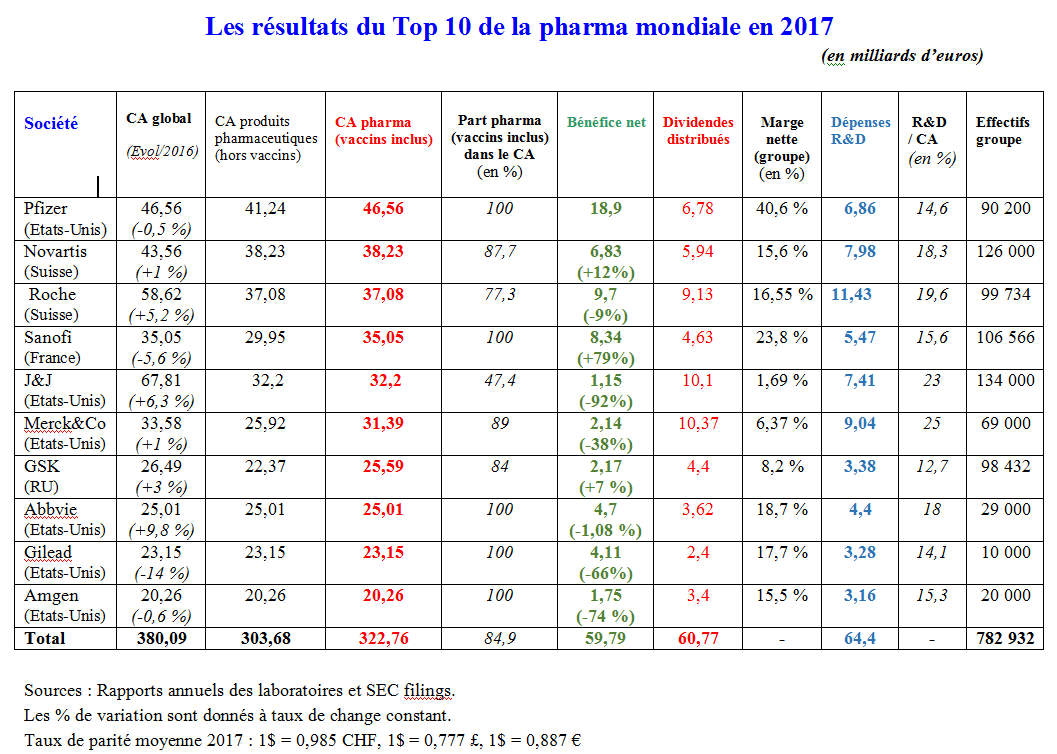
En 2017, le top 10 de l’industrie pharmaceutique a réalisé un chiffre d’affaires global de 322,76 milliards d’€ (+ 2,07 %) pour un bénéfice de 59,79 milliards d’€ (-14%). Ses dépenses de R&D ont atteint 64,4 milliards d’€ (+1,8%) tandis que le montant des dividendes versés aux actionnaires s’est élevé à 60,48 milliards d’euros. Pour la troisième année consécutive, le classement de la big pharma consacre le même trio de tête, l’américain Pfizer occupant la pole position, devant les suisses Novartis et Roche.
L’écart de chiffre d’affaires entre les deux premiers du top 10, Pfizer et Novartis, reste conséquent, même s’il repasse cette année sous la barre des dix milliards de $ pour atteindre 9,3 milliards de $ (8,33 milliards d’€). Quant à Roche, il n’est séparé de Novartis que par 1,15 milliard d’€ de chiffre d’affaires. Le Français Sanofi conserve sa 4ème place, suivi par l’américain Johnson&Johnson qui maintenant devance son compatriote Merck&Co. Le britannique GSK gagne une place et prend la 7ème position à Gilead, dorénavant 9ème derrière AbbVie qui progresse à la 8ème. Enfin, un des pionniers de la biotech, l’américain Amgen fait pour la première fois son entrée dans le top 10 au détriment du britannique AstraZeneca.
Resserrement du périmètre chez Pfizer
Après avoir renforcé son portefeuille en dermatologie, en thérapie génique et en oncologie avec les rachat de ses compatriotes Anacor, Bamboo Therapeutics et Medivation en 2016, Pfizer continue à réviser son périmètre d’activité. Le groupe américain a ainsi choisi d’abandonner les neurociences. Cette décision implique l’arrêt du développement d’un portefeuille de huit produits en phase précoce pour le traitement de l’épilepsie, de la maladie d’Alzheimer, de la maladie de Parkinson et de la schizophrénie, les financements alloués à ces travaux devant être reportés sur d’autres aires thérapeutiques. Autre secteur dont l’avenir reste en suspens, l’automédication (Consumer Healthcare) doit faire l’objet d’une décision stratégique cette année, Pfizer envisageant de s’en séparer via la création d’une spin-off, voire une cession pure et simple. En progression de 2 %, à 3,47 milliards de $ (3,07 milliards d’€) en 2017, cette activité est comptabilisée dans la division « santé innovante » qui constitue le moteur majeur de la croissance du groupe.
En 2017, Pfizer a franchi pour la première fois la barre des 40 milliards d’€ de ventes annuelles. Avec un résultat de 31,42 milliards de $ (27,87 milliards d’€, +8%), la division « santé innovante » contribue à près de 60 % à ce résultat. Elle inclut notamment six des sept blockbusters de l’américain dont le vaccin contre le pneumocoque Prevnar13 qui réalise plus de cinq milliards de ventes. On notera aussi qu’Ibrance® indiqué dans le cancer du sein HR+, HER2 depuis 2015 aux Etats-Unis et 2016 en Europe, représente déjà la moitié des ventes de la franchise oncologie (3,12 milliards de $/2,76 milliards d’€ par rapport à 6,05 milliards de $/5,54 milliards d’€). Parallèlement, la division Santé Essentielle recule de 11 %, à 21,1 milliards de $ (18,71 milliards d’€), la baisse affectant l’ensemble des produits à l’exception notable des biosimilaires. Ces derniers ont vu leurs ventes augmenter de 67% pour atteindre 531 millions de $ (471 millions d’€) grâce à un biosimilaire de Remicade® (infliximab), Inflectra®/Remsima® dont les ventes ont atteint 419 millions de $ (371,6 millions d’€) en 2017 contre 192 en 2016. Cette franchise devrait poursuivre sa progression. L’acquisition d’Hospira en 2015 permet à Pfizer de disposer maintenant d’un portefeuille de 13 biosimilaires dont trois sont en cours d’enregistrement (biosimilaires de filgrastim, du trastuzumab et epoetine alpha) et trois en phase 3 (biosimilaires de rituximab, adalimumab et bevacizumab).
Par ailleurs, Pfizer, qui affiche un bénéfice exceptionnel grâce à un crédit d’impôt de 11 milliards de $ dû à la réforme fiscale américaine, a versé 7,7 milliards de $ de dividendes à ses actionnaires en 2017. Un programme d’investissements de cinq milliards de $ sur cinq ans a aussi été annoncé aux Etats-Unis, notamment pour y renforcer la production du groupe.
Novartis en quête de croissance
L’heure est aussi au désengagement du secteur de l’automédication chez le n°2 du top 10 de l’industrie pharmaceutique. Novartis vient de céder à GSK pour 13 milliards de $ la participation qu’il détenait au sein de leur joint-venture OTC. La société avait été créée dans le cadre de l’accord de 2014 qui avait conduit à la cession des vaccins du Suisse au Britannique en échange de son portefeuille en oncologie. Alors que le nouveau directeur général, Vas Narasimhan qui a succédé à Joe Jimenez le 1er février dernier, a pour mission de lancer une nouvelle phase de croissance pour Novartis, la cession de cet actif non stratégique pour le groupe pourrait laisser présager de futures acquisitions. Depuis l’absorption de l’oncologie de GSK, le Suisse n’a réalisé qu’un nombre limitié d’opérations ciblées dans les domaines de la dermatologie, du système nerveux central et des maladies rares. Le dernier rachat en date est celui d’Advanced Accelerator Applications, société française spécialiste de la médecine nucléaire moléculaire, pour 3,9 milliards de $. L’opération a été finalisé en janvier, quelques jours avant l’annonce de l’autorisation, aux Etats-Unis, de son traitement des tumeurs neuroendocrines gastroentéropancréatiques, Lutathera® déjà autorisé en Europe depuis septembre 2017.
Au niveau des ventes, la division Médicaments innovants a représenté 76% des ventes pharmaceutiques du groupe et 67 % des ventes totales. Neuf des 20 produits ayant enregistré les meilleures ventes en 2017 relèvent de l’oncologie et réalisent un tiers des ventes pharma de Novartis. Alors que Glivec®, maintenant tombé dans le domaine public, conserve encore un chiffre d’affaires de près de deux milliards de $ en 2016 (-41%), Novartis a besoin de pouvoir miser sur de nouveaux relais de croissance au sein de cette franchise. On notera d’ailleurs que les quatre nouvelles entités moléculaires (NEM) dont le groupe a obtenu l’autorisation en 2017 sont toutes destinées à des indications en oncologie. Outre la première thérapie CAR-T autorisée dans le monde, Kymriah® pour la leucémie aïguë lymphoblastique, et Lutathera®, les deux autres NEM approuvées sont indiquées pour le cancer du sein HR+/HER2- et pour une forme de leucémie myéloïde aiguë. 2018 devrait également voir le dépôt de quatre dossiers en oncologie (alpelisib pour le cancer du sein HR+/HER2- en 2ème ligne, alpelisib pour le traitement adjuvant du cancer du sein HR+/HER2-, osilodrostat pour la maladie de Cushing et eltrombopag pour l’anémie aplasique). Enfin, Novartis devrait aussi demander l’autorisation du siponimod pour la forme progressive de la sclérose en plaques, de la clofazimine pour la tuberculose multirésistante et du brolucizumab pour la dégénérescence maculaire liée à l’âge.
Roche face aux biosimilaires
Chez son compatriote Roche, l’oncologie représente 62,5 % des 41,2 milliards de francs suisses (37,08 milliards d’€/ +5%) des ventes réalisées dans le secteur pharmaceutique en 2017. Au sein de cette division, quatre produits, Herceptin®), Avastin®, Mabthera®/Rituxan® et Perjeta®, totalisent 84 % des résultats. Néanmoins, ceux-ci devraient commencer à s’éroder en raison de l’arrivée des biosimilaires. Les premiers biosimilaires de Mabthera®/Rituxan® (rituximab) ont été lancés en Europe à partir de la mi-2017 tandis que les brevets de l’anticorps anti CD20 n’expireront qu’à partir de la mi-2018 aux Etats-Unis. Herceptin® et Avastin® devraient quant à eux affronter la concurrence des biosimilaires à partir de mi-2019 aux Etats-Unis. Parallèlement, le groupe suisse continue à renouveler son portefeuille de médicaments. Son anticorps anti immune checkpoint inhibitor, l’anti PD-L1 Tecentriq® (atezolizumab) a été approuvé en 2017 en Europe dans le cancer des poumons et dans le cancer de la vessie. Déjà autorisé en 2016 aux Etats-Unis, il est aussi évalué dans plusieurs formes de tumeurs solides (mélanome, carcinome rénal, cancer du sein triple négatif, cancer des ovaires, cancer de la prostate…), indications pour lesquelles il est actuellement en phase 2 ou en phase 3. Une vingtaine d’autres molécules sont également en clinique pour le traitement de tumeurs solides ou de cancers hématologiques dont trois en phase 3, l’idasanutline (antagoniste de la protéine MDM2) en leucémie myéloïde aiguë, l’ipatasertib (inhibiteur d’Akt) pour le cancer de la prostate et le taselisib (inhibiteur de la phosphoinositide 3-kinase) pour le cancer du sein HR+/HER2-. Le dépôt de la demande d’autorisation de ce dernier est prévue cette année. Enfin, Roche a aussi choisi d’élargir son potentiel en oncologie avec le rachat fin 2017 du californien Ignyta pour 1,7 milliard de $. L’opération lui permet d’intégrer un portefeuille alliant thérapies ciblées (inhibiteurs de tyrosine kinases, inhibiteur de la voie hedgehog…) et diagnostics compagnons capables d’agir sur différents types de cancers présentant des mutations identiques.
Roche renforce également ses activités en immunologie et développe un portefeuille d’une dizaine d’anticorps ciblant les principales pathologies autoimmunes. Le Suisse a obtenu l’autorisation en Europe et aux Etats-Unis du premier traitement indiqué dans les deux formes de sclérose en plaques, Ocrevus® (ocrelizumab). Il dispose aussi de l’étrolizumab (anticorps dirigé contre la sous-unité β7 de l’intégrine) en phase 3 dans la maladie de Crohn. Enfin, le groupe vient d’obtenir l’autorisation d’un traitement de l’hémophilie A avec inhibiteurs, Hemlibra® (emicizumab) dont les ventes sont estimées à1,635 milliard de $ en 2022. Issu de sa filiale japonaise Chugai, cet anticorps bispécifique doit aussi faire l’objet d’une demande d’enregistrement cette année pour l’hémophilie A sans inhibiteurs.
Sanofi s’étoffe en immunologie et en hémophilie
En 2017, Sanofi a poursuivi la mise en place de sa feuille de route stratégique annoncée en novembre 2015. Alors que sa division Médecine générale et marchés émergents affiche une baisse de 1%, à 14,04 milliards d’euros, Sanofi Genzyme continue à se positionner comme le principal moteur de croissance pour le groupe pharmaceutique français. Avec un résultat de 5,67 milliards d’euros, les ventes de cette division dévolue à la médecine de spécialité ont progressé de plus de 15% en 2017. Celles-ci devraient aussi profiter de l’autorisation obtenue en 2017 pour deux anticorps monoclonaux issus de sa collaboration avec Regeneron, Dupixent® (dupilumab) dans la dermatite atopique et Kevzara® (sarilumab) dans la polyarthrite rhumatoïde. Le partenariat qui l’associe à l’américain depuis 2003 devrait aussi contribuer à étoffer le portefeuille en oncologie de Sanofi, avec notamment un anticorps anti immune checkpoint inhibitor, le cemiplimab. Cet anti PD-1 est en développement pour le cancer du poumon non à petites cellules, le cancer du col de l’utérus, le carcinome basocellulaire et le carcinome épidermoïde cutané avancé, indication pour laquelle il est en cours d’évalution en Europe. Autre partenariat fructueux conclu par Sanofi, les travaux menés avec l’américain Alnylam depuis 2012 ont conduit au dépôt de la demande d’autorisation en Europe du patisiran, ARN interférent candidat au traitement de l’amylose héréditaire à transthyrétine de l’adulte.
Le groupe français vient également de se renforcer dans le domaine des anticorps pour le traitement de maladies inflammatoires avec le rachat du belge Ablynx pour 3,9 milliards d’euros et dans les maladies rares en reprenant l’américain Bioverativ pour 11,6 milliards de $ (9,47 milliards d’euros). Cette société américaine est la spin-off de l’activité hémophilie de la biotech Biogen. Créée en 2016, elle assure la commercialisation des traitements de l’hémophilie A et de l’hémophilie B, Eloctate® et Alprolix®, et développe aussi des anticorps bispécifiques et des thérapies géniques qui viendront s’ajouter au fitusiran, ARN interférent sur lequel Sanofi travaille avec Alnylam.
Dans le domaine du diabète, les ventes du groupe français ont baissé de 11,1 % à 6,39 milliards d’euros. Son insuline phare Lantus®, (insuline glargine), maintenant confrontée à la concurrence des biosimilaires, a enregistré un recul de 17,5 %, à 4,62 milliards d’euros. Lancées en 2017, sa nouvelle génération d’insuline glargine Toujeo®, et sa combinaison d’insuline glargine et de lixisénatide Suliqua® atteignent respectivement 816 millions d’euros (+27%) et 26 millions d’euros. Sanofi mise aussi sur le développement de nouveaux actifs tels que la sotaglifozine développée avec l’américain Lexicon ou l’efpéglénatide mis au point avec le coréen Hanmi Pharmaceuticals. L’agence européenne du médicament vient d’accepter le dossier de demande d’autorisation du premier pour le diabète de type 1 tandis que le second fait l’objet d’un programme de phase III dans le diabète de type 2 depuis décembre dernier. Enfin, Sanofi est aussi actif dans les biosimilaires d’insuline et a reçu en juillet dernier une AMM pour sa version biosimilaire de l’insuline lispro Humalog® pour le diabète de type 1 et de type 2. Par ailleurs, le groupe français qui a finalisé l’année dernière la reprise de l’activité Santé grand public de l’allemand Boehringer Ingelheim, mise aussi sur sa franchise vaccins et consolide cette activité en Europe après la dissolution de sa co-entreprise avec Merck&Co, Sanofi Pasteur MSD. Il renforce aussi ses capacités de production et élargit son offre de vaccins avec l’acquisition de l’américain Protein Sciences qui lui permet de disposer d’un vaccin antigrippal à base de protéines recombinantes homologué par la FDA. De plus, Sanofi collabore maintenant avec MedImmune pour développer un anticorps monoclonal destiné à la prévention des maladies associées au virus respiratoire syncytial (VRS).
Johnson&Johnson continue sa progression
7ème en 2015 derrière Gilead, 6ème en 2016 derrière Merck&Co, Johnson&Johnson progresse à nouveau d’une place pour atteindre la 5ème place du top 10. Alors que les ventes du groupe ont progressé de plus de 8 %, à 36,25 milliards de $ (32,2 milliards d’€), l’immunologie reste son aire thérapeutique majeure. Néanmoins, ses résultats n’ont progressé que de 2,3 %, à 12.24 milliards de $ (10,86 milliards d’€), en raison du recul de Remicade® (infliximab) qui subit l’impact des biosimilaires depuis 2015. Cet anticorps anti TNFα, qui a représenté 51 % des ventes de la division immunologie et 8,3 % des ventes globales du groupe, a enregistré une baisse de 9,3 % en 2017. Parallèlement, Stelara® (ustekinumab), indiqué dans la maladie de Crohn, le psoriasis et le rhumatisme psoriasique, augmente de 24 % et dépasse quatre milliards de $ de ventes en 2017. Johnson&Johnson mise également sur son nouveau traitement du psoriasis, Tremfya® (guselkumab). Les ventes de cet anticorps anti-interleukine 23 autorisé en Europe et aux Etats-Unis en 2017 pourraient atteindre 1,559 milliard de $ en 2022.
La division oncologie de J&J affiche quant à elle une santé florissante. En hausse de 25 %, à 7,25 milliards de $ (6,43 milliards d’€), ses ventes bénéficient des performances de Darzalex® (daratumumab), utilisé pour le traitement du myélome et d’Imbruvica® (ibrutinib) indiqué dans le traitement de lymphomes non hodgkiniens. Cet inhibiteur de la tyrosine de kinase commercialisé avec AbbVie a vu ses ventes progresser de 51 %, à 1,89 milliard de $ (1,67 milliards d’€). Les ventes de la division oncologie pourraient encore être gonflées dès l’année prochaine par l’arrivée de l’apalutamide dont le dossier a été déposé à la FDA en 2017 pour le cancer de la prostate. Ses ventes sont évaluées à 1,629 milliard de $ en 2022. Le groupe a aussi récolté les premiers fruits de l’acquisition d’Actelion finalisée en juin dernier. L’intégration de la biotech a ajouté une sixième aire thérapeutique au périmètre de J&J, avec une franchise hypertension artérielle pulmonaire constituée de trois produits (Opsumit®, Tracleer® et Uptravi®). Dans le domaine du VIH, des demandes d’enregistrement sont aussi en cours pour une combinaison de dolutegravir et de rilpivirine (Juluca®) en Europe et pour une combinaison darunavir/ cobicistat/ emtricitabine/tenofovir alafenamide (Symtuza®) aux Etats-Unis.
Merck&Co porté par l’immunothérapie
Rétrogradé à la 6ème place en 2017, Merck&Co a enregistré une progression de ses ventes d’1%, soutenu par les résultats de son traitement de l’hépatite C Zepatier® (ventes d’1,66 milliard de $, +199%) et par sa division oncologie avec la dynamique des ventes de Keytruda® (pembrolizumab). Initialement autorisé en 2015 pour le traitement du mélanome, son anticorps anti PD-1 est maintenant approuvé dans six autres indications (cancer gastrique exprimant le marqueur PD-L1, cancer de la vessie, cancer du poumon non à petites cellules, lymphome de Hodgkin, cancer tête et cou, cancers avec une instabilité des microsatellites ou présentant un système de réparation des mésappariements déficient). Ses ventes ont dépassé trois milliards de $, à 3,809 milliards de $ (3,37 milliards d’€, +172%) en 2017 et devraient poursuivre sur cette voie en 2018, soutenues par l’extension de ses indications. Un important programme clinique utilisant Keytruda® seul ou en combinaison est en cours dans plus d’une trentaine de types de cancers dont les cancers du sein triple négatif, le cancer de la prostate, le cancer des ovaires ou le cancer colorectal.
Par ailleurs, les résultats de Merck&Co dans le domaine des vaccins augmentent de 6%, à 6,15 milliards de $ (5,45 milliards d’€), portés à la fois par la progression de ses vaccins Gardasil® contre le papillomavirus humain et par l’intégration de ses ventes de vaccins en Europe comptabilisées auparavant au sein de sa joint-venture avec Sanofi, Sanofi Pasteur MSD, dissoute fin 2016. Enfin, plusieurs dossiers d’enregistrement sont en cours d’évaluation aux Etats-Unis, en Europe ou au Japon pour le traitement du diabète (ertuglifozine, combinaisons ertuglifozine et sitagliptine, ertuglifozine et metformine, sitagliptine et ipraglifozine) et pour le traitement du VIH (doravirine – MK-1439, combinaison doravirine/lamivudine/tenofovir disoproxil fumarate – MK-1439A).
Par ailleurs, le groupe continue à élargir sa palette dans l’immunothérapie anticancéreuse avec l’acquisition récente de deux biotech spécialistes respectivement de l’immunité innée et des virus oncolytiques. La première, l’allemande Rigontec, développe des traitements ciblant la voie de signalisation RIG-1 (retinoic acid-inducible gene I) afin d’induire une immunité antitumorale à la fois à court terme et à long terme. La seconde, l’australienne Viralytics, met au point des virus oncolytiques et un accord de recherche clinique unissait déjà les deux sociétés pour un essai combinant Keytruda® et le produit lead de Viralytics, Cavatax® dans le mélanome et les cancers du poumon, de la prostate et de la vessie.
GSK mise sur l’automédication et les vaccins
Avec des ventes en progression de 3 % en 2017, le britannique GSK est cette année le premier laboratoire du top 10 dont le chiffre d’affaires pharmaceutique est inférieur à 30 milliards d’euros. Ses ventes de médicaments de prescription ont augmenté de 7 %, à 19,71 milliards d’€ tandis que ses ventes de vaccins le positionnent parmi les leaders du secteur grâce à des ventes de 5,88 milliards d’€ (+6 %). Le groupe figure ainsi parmi les leaders pour la vaccination contre la méningite. Sa gamme de vaccins qui inclut Bexsero® et Menveo® issus de l’accord de 2015 avec le suisse Novartis, a atteint des ventes de 780 millions d’euros en 2017. Pour le futur, GSK mise aussi sur son nouveau vaccin contre le zona, Shingrix® autorisé en Europe et aux Etats-Unis en 2017. Le britannique développe également un portefeuille de vaccins contre le virus respiratoire syncytial (VRS). Par ailleurs, le groupe commence à tirer parti du renouvellement de sa gamme respiratoire où il a réalisé plus de 40 % de ses ventes (6,991 milliards de livres – 7,976 milliards d’€ /+ 3% ) en 2017. Au cœur de ses priorités, la bronchopneumopathie chronique obstructive (BPCO), maladie pour laquelle GSK a demandé en 2017 l’autorisation de son anticorps anti-interleukine 5, Nucala® (mepolizumab), déjà approuvé depuis 2015 en Europe et aux Etats-Unis pour le traitement de l’asthme sévère à éosinophiles. Deux autres candidats sont également en phase 2 dans cette indication, la danirixine (antagoniste du récepteur CXCR2) et une molécule first-in-class, le nemiralisib (inhibiteur de la PI3Kδ).
Parallèlement GSK mise aussi sur l’automédication et a décidé de racheter la participation de son partenaire Novartis dans leur joint-venture OTC (voir ci-dessus). Enfin, le groupe britannique, dont la R&D est maintenant présidée par Hal Barron, précédemment à la tête de la R&D de Calico, a choisi de recentrer les priorités de sa recherche. Ses activités se concentrent dorénavant sur quatre thématiques (maladies respiratoires, VIH, oncologie, immuno-inflammation). Dans le domaine du cancer, le groupe britannique vise en particulier le développement d’un portefeuille comprenant à la fois des petites molécules, des anticorps, des molécules multispécifiques, des adjuvants et des thérapies cellulaires utilisés seul ou en combinaison.
AbbVie continue à grimper
Entré en 10ème position du top 10 en 2015, l’américain AbbVie a encore gagné une place en 2017. Le groupe issu de la scission d’Abbott en 2013 a enregistré une progression de ses ventes de près de 10 %, à 28,2 milliards de $ (25,01 milliards d’€). Avec un chiffre d’affaires de plus de 18 milliards de $ (16 milliards d’€) en 2017, son principal produit, Humira® (adalimumab), représente 65 % des ventes. Bien que cet anticorps anti TNFα soit en passe de perdre ses brevets dans le monde, AbbVie vise toujours une poursuite de l’augmentation de ses ventes évaluées à 21 milliards de $ en 2020 (1). Parallèlement, le reste du portefeuille du groupe a généré un résultat de 9,7 milliards de $ (8,6 milliards d’€) et a bénéficié du fort accroissement des résultats d’Imbruvica® (ibrutinib). Autorisé dans cinq indications (lymphome à cellules du manteau, leucémie lymphoïde chronique, maladie de Waldenström, lymphome de la zone marginale, réaction du greffon contre l’hôte), cet inhibiteur de la tyrosine kinase de Bruton développé par Pharmacyclics a vu ses ventes progresser de 40 % et a dépassé la barre des deux milliards de $ en 2017. AbbVie table également sur Mavyret®/Maviret® (glecaprevir/pibrentasvir) qui vient d’être autorisé contre les six génotypes du virus de l’hépatite C. Le lancement de cette nouvelle combinaison d’agents antiviraux à action directe pourrait contrebalancer le recul de sa franchise VHC dont les ventes ont diminué de 16 % en 2017. De plus, le groupe américain peut aussi compter sur son portefeuille de produits en développement. Parmi les autres produits les plus avancés, on relèvera l’upadacitinib (ABT-494 – inhibiteur de JAK1) qui vient de recevoir le statut de Breakthrough Therapy pour la dermatite atopique et est actuellement en phase 3 dans la polyarthrite rhumatoïde et dans la maladie de Crohn. Dans cette dernière indication, AbbVie étudie un anticorps dirigé contre l’interleukine-23, le risankizumab, également en phase 3 pour le psoriasis. Deux nouvelles demandes d’autorisation ont aussi été déposées en 2017. La première concerne un élargissement des indications du venetoclax dans la leucémie lymphoïde chronique tandis que la seconde porte sur un antagoniste de l’hormone de libération des gonadotrophines, l’elagolix, dans l’endométriose.
Gilead : du VHC aux CAR-T
Alors que la compétition est de plus en plus forte sur un marché de l’hépatite C où une dizaine d’antiviraux ou de combinaisons d’antiviraux sont maintenant disponibles, le leader du secteur a subi un recul de ses ventes de 14 % en 2017, à 26,1 milliards de $ (23,15 milliards d’€). Le produit le plus affecté est Harvoni® (sofosbuvir et ledispavir). Ses ventes ont chuté de 52% à 4,37 milliards de $ (3,86 milliards d’€) et ne représentent plus que 19 % des résultats de la société, contre 49 % en 2015. Si le chiffre d’affaires 2018 devrait bénéficier de l’impact de l’autorisation de Sovaldi® (sofosbuvir) en Chine, Gilead a continué en parallèle à renforcer l’éventail de ses aires thérapeutiques. Après avoir choisi en 2016 d’investir dans le secteur de la stéatose hépatique non alcoolique, l’américain a frappé un grand coup en entrant de plain pied dans l’univers hyperactif et très concurrentiel des thérapies CAR-T (Chimeric Antigen Receptor T-cell – cellules T porteuses d’un récepteur chimérique). L’opération a été réalisée avec le rachat, pour 11,9 milliards de $, d’un des leaders du domaine, le californien Kite Pharma, dont le produit phare, Yescarta® (axicabtagene ciloleucel – KTE-C19) a été autorisé en octobre dernier. Cette première transaction a ensuite été consolidée par l’acquisition d’une autre biotech californienne, Cell Design Labs, afin de se doter de nouvelles plateformes pour le développement de nouvelles thérapies CAR-T.
Amgen, 1er biotech du top 10
Pour la première fois en 2017, une biotech fait son entrée dans le top 10 de l’industrie pharmaceutique. C’est dorénavant l’américain Amgen qui occupe la dixième place du classement, au détriment d’AstraZeneca qui affiche des revenus 2017 inférieurs de 384 millions de $ (340 millions d’€) à ceux du pionnier de la biotech fondé en 1980. La société active dans six aires thérapeutiques (onco-hématologie, santé osseuse, maladies cardiovasculaires, neurosciences, inflammation et néphrologie), a engrangé un revenu de 22,8 milliards de $ (20,26 milliards d’€) en 2017. Sept de ses produits (Enbrel®, Neulasta®, Aranesp®, Prolia®, Sensipar®/Mimpara®, Xgeva® et Epogen®) affichent des ventes supérieures au milliard de $. L’année écoulée a été marquée notamment par l’extension de son accord avec Novartis pour la commercialisation conjointe aux Etats-Unis d’Aimovig® (erenumab), en cours d’évaluation par la FDA pour le traitement de la migraine. Enfin, à l’instar de Pfizer, de Novartis via sa filiale Sandoz et de Merck&Co à travers son partenariat avec Samsung Bioepis, Amgen est très actif sur le front des biosimilaires. Il devrait pouvoir lancer dès cette année son biosimilaire d’Humira®, Amgevita® et a obtenu l’autorisation aux Etats-Unis de Mvasi®, biosimilaire d’Avastin® (bevacizumab). Des versions biosimilaires du cetuximab, de l’infliximab, du rituximab, de l’eculizumab et du trastuzumab sont aussi en développement en phase 3.
Le même trio de tête en 2022 ?
Alors que les estimations d’Evaluate Pharma placent Novartis, Pfizer et Roche dans un mouchoir de poche avec des ventes évaluées respectivement à 49,8 ; 49,7 et 49,6 milliards de $ en 2022, les rangs se resserrent entre les leaders de l’industrie pharmaceutique. Une nouvelle falaise de brevets se prépare avec la concurrence des biosimilaires qui arrive maintenant pour les principaux blockbusters biotech , son pic étant attendu en 2020. L’impact des biosimilaires devrait jouer un rôle majeur sur les prochains classements du top 10. Si AbbVie, Roche et Pfizer figurent parmi les plus menacés, les deux premiers disposent d’un solide portefeuille de produits en développement tandis que le n°1 du top 10 est actif sur les deux tableaux depuis son investissement dans l’acquisition d’Hospira en 2015. Après une année 2017 sous le signe des CAR-T avec l’autorisation de deux premières immunothérapies anticancéreuses basées sur ces cellules et avec l’acquisition des leaders Kite Pharma par Gilead et Juno Therapeutics par Celgene, les cartes pourraient être rapidement rebattues. L’érosion importante des ventes de sa franchise VHC pourrait conduire Gilead à sortir du top 10, tandis que Celgene pourrait y entrer sous l’effet conjugué du rachat de Juno et des ventes de son produit leader Revlimid® (lénalidomide). Ses ventes qui ont dépassé huit milliards de $ en 2017 sont estimées à plus de 14 milliards en 2022. La surprise pourrait aussi venir du pays du soleil levant avec l’arrivée d’un premier industriel japonais dans le top 10. Au cas où Takeda finaliserait l’offre de rachat envisagée sur le britannique Shire, les ventes cumulées des deux entités pourraient dépasser les 31 milliards de $ et propulser le groupe nippon dans la première moitié du classement.
Anne-Lise Berthier
Rédactrice en chef de BioPharmAnalyses
(1) Le brevet portant sur la composition d’Humira® a expiré en décembre 2016 aux Etats-Unis et arrivera à son terme dans la plupart des pays européens en octobre 2018.
Top 10 de la pharma : un classement bousculé en 2017
En 2017, le top 10 de l’industrie pharmaceutique a réalisé un chiffre d’affaires global de 322,76 milliards d’€ (+ 2,07 %) pour un bénéfice de 59,79 milliards d’€ (-14%). Ses dépenses de R&D ont atteint 64,4 milliards d’€ (+1,8%) tandis que le montant des dividendes versés aux actionnaires s’est élevé à 60,48 milliards d’euros. Pour la troisième année consécutive, le classement de la big pharma consacre le même trio de tête, l’américain Pfizer occupant la pole position, devant les suisses Novartis et Roche.
L’écart de chiffre d’affaires entre les deux premiers du top 10, Pfizer et Novartis, reste conséquent, même s’il repasse cette année sous la barre des dix milliards de $ pour atteindre 9,3 milliards de $ (8,33 milliards d’€). Quant à Roche, il n’est séparé de Novartis que par 1,15 milliard d’€ de chiffre d’affaires. Le Français Sanofi conserve sa 4ème place, suivi par l’américain Johnson&Johnson qui maintenant devance son compatriote Merck&Co. Le britannique GSK gagne une place et prend la 7ème position à Gilead, dorénavant 9ème derrière AbbVie qui progresse à la 8ème. Enfin, un des pionniers de la biotech, l’américain Amgen fait pour la première fois son entrée dans le top 10 au détriment du britannique AstraZeneca.

Resserrement du périmètre chez Pfizer
Après avoir renforcé son portefeuille en dermatologie, en thérapie génique et en oncologie avec les rachat de ses compatriotes Anacor, Bamboo Therapeutics et Medivation en 2016, Pfizer continue à réviser son périmètre d’activité. Le groupe américain a ainsi choisi d’abandonner les neurociences. Cette décision implique l’arrêt du développement d’un portefeuille de huit produits en phase précoce pour le traitement de l’épilepsie, de la maladie d’Alzheimer, de la maladie de Parkinson et de la schizophrénie, les financements alloués à ces travaux devant être reportés sur d’autres aires thérapeutiques. Autre secteur dont l’avenir reste en suspens, l’automédication (Consumer Healthcare) doit faire l’objet d’une décision stratégique cette année, Pfizer envisageant de s’en séparer via la création d’une spin-off, voire une cession pure et simple. En progression de 2 %, à 3,47 milliards de $ (3,07 milliards d’€) en 2017, cette activité est comptabilisée dans la division « santé innovante » qui constitue le moteur majeur de la croissance du groupe.
En 2017, Pfizer a franchi pour la première fois la barre des 40 milliards d’€ de ventes annuelles. Avec un résultat de 31,42 milliards de $ (27,87 milliards d’€, +8%), la division « santé innovante » contribue à près de 60 % à ce résultat. Elle inclut notamment six des sept blockbusters de l’américain dont le vaccin contre le pneumocoque Prevnar13 qui réalise plus de cinq milliards de ventes. On notera aussi qu’Ibrance® indiqué dans le cancer du sein HR+, HER2 depuis 2015 aux Etats-Unis et 2016 en Europe, représente déjà la moitié des ventes de la franchise oncologie (3,12 milliards de $/2,76 milliards d’€ par rapport à 6,05 milliards de $/5,54 milliards d’€). Parallèlement, la division Santé Essentielle recule de 11 %, à 21,1 milliards de $ (18,71 milliards d’€), la baisse affectant l’ensemble des produits à l’exception notable des biosimilaires. Ces derniers ont vu leurs ventes augmenter de 67% pour atteindre 531 millions de $ (471 millions d’€) grâce à un biosimilaire de Remicade® (infliximab), Inflectra®/Remsima® dont les ventes ont atteint 419 millions de $ (371,6 millions d’€) en 2017 contre 192 en 2016. Cette franchise devrait poursuivre sa progression. L’acquisition d’Hospira en 2015 permet à Pfizer de disposer maintenant d’un portefeuille de 13 biosimilaires dont trois sont en cours d’enregistrement (biosimilaires de filgrastim, du trastuzumab et epoetine alpha) et trois en phase 3 (biosimilaires de rituximab, adalimumab et bevacizumab).
Par ailleurs, Pfizer, qui affiche un bénéfice exceptionnel grâce à un crédit d’impôt de 11 milliards de $ dû à la réforme fiscale américaine, a versé 7,7 milliards de $ de dividendes à ses actionnaires en 2017. Un programme d’investissements de cinq milliards de $ sur cinq ans a aussi été annoncé aux Etats-Unis, notamment pour y renforcer la production du groupe.
Novartis en quête de croissance
L’heure est aussi au désengagement du secteur de l’automédication chez le n°2 du top 10 de l’industrie pharmaceutique. Novartis vient de céder à GSK pour 13 milliards de $ la participation qu’il détenait au sein de leur joint-venture OTC. La société avait été créée dans le cadre de l’accord de 2014 qui avait conduit à la cession des vaccins du Suisse au Britannique en échange de son portefeuille en oncologie. Alors que le nouveau directeur général, Vas Narasimhan qui a succédé à Joe Jimenez le 1er février dernier, a pour mission de lancer une nouvelle phase de croissance pour Novartis, la cession de cet actif non stratégique pour le groupe pourrait laisser présager de futures acquisitions. Depuis l’absorption de l’oncologie de GSK, le Suisse n’a réalisé qu’un nombre limitié d’opérations ciblées dans les domaines de la dermatologie, du système nerveux central et des maladies rares. Le dernier rachat en date est celui d’Advanced Accelerator Applications, société française spécialiste de la médecine nucléaire moléculaire, pour 3,9 milliards de $. L’opération a été finalisé en janvier, quelques jours avant l’annonce de l’autorisation, aux Etats-Unis, de son traitement des tumeurs neuroendocrines gastroentéropancréatiques, Lutathera® déjà autorisé en Europe depuis septembre 2017.
Au niveau des ventes, la division Médicaments innovants a représenté 76% des ventes pharmaceutiques du groupe et 67 % des ventes totales. Neuf des 20 produits ayant enregistré les meilleures ventes en 2017 relèvent de l’oncologie et réalisent un tiers des ventes pharma de Novartis. Alors que Glivec®, maintenant tombé dans le domaine public, conserve encore un chiffre d’affaires de près de deux milliards de $ en 2016 (-41%), Novartis a besoin de pouvoir miser sur de nouveaux relais de croissance au sein de cette franchise. On notera d’ailleurs que les quatre nouvelles entités moléculaires (NEM) dont le groupe a obtenu l’autorisation en 2017 sont toutes destinées à des indications en oncologie. Outre la première thérapie CAR-T autorisée dans le monde, Kymriah® pour la leucémie aïguë lymphoblastique, et Lutathera®, les deux autres NEM approuvées sont indiquées pour le cancer du sein HR+/HER2- et pour une forme de leucémie myéloïde aiguë. 2018 devrait également voir le dépôt de quatre dossiers en oncologie (alpelisib pour le cancer du sein HR+/HER2- en 2ème ligne, alpelisib pour le traitement adjuvant du cancer du sein HR+/HER2-, osilodrostat pour la maladie de Cushing et eltrombopag pour l’anémie aplasique). Enfin, Novartis devrait aussi demander l’autorisation du siponimod pour la forme progressive de la sclérose en plaques, de la clofazimine pour la tuberculose multirésistante et du brolucizumab pour la dégénérescence maculaire liée à l’âge.
Roche face aux biosimilaires
Chez son compatriote Roche, l’oncologie représente 62,5 % des 41,2 milliards de francs suisses (37,08 milliards d’€/ +5%) des ventes réalisées dans le secteur pharmaceutique en 2017. Au sein de cette division, quatre produits, Herceptin®), Avastin®, Mabthera®/Rituxan® et Perjeta®, totalisent 84 % des résultats. Néanmoins, ceux-ci devraient commencer à s’éroder en raison de l’arrivée des biosimilaires. Les premiers biosimilaires de Mabthera®/Rituxan® (rituximab) ont été lancés en Europe à partir de la mi-2017 tandis que les brevets de l’anticorps anti CD20 n’expireront qu’à partir de la mi-2018 aux Etats-Unis. Herceptin® et Avastin® devraient quant à eux affronter la concurrence des biosimilaires à partir de mi-2019 aux Etats-Unis. Parallèlement, le groupe suisse continue à renouveler son portefeuille de médicaments. Son anticorps anti immune checkpoint inhibitor, l’anti PD-L1 Tecentriq® (atezolizumab) a été approuvé en 2017 en Europe dans le cancer des poumons et dans le cancer de la vessie. Déjà autorisé en 2016 aux Etats-Unis, il est aussi évalué dans plusieurs formes de tumeurs solides (mélanome, carcinome rénal, cancer du sein triple négatif, cancer des ovaires, cancer de la prostate…), indications pour lesquelles il est actuellement en phase 2 ou en phase 3. Une vingtaine d’autres molécules sont également en clinique pour le traitement de tumeurs solides ou de cancers hématologiques dont trois en phase 3, l’idasanutline (antagoniste de la protéine MDM2) en leucémie myéloïde aiguë, l’ipatasertib (inhibiteur d’Akt) pour le cancer de la prostate et le taselisib (inhibiteur de la phosphoinositide 3-kinase) pour le cancer du sein HR+/HER2-. Le dépôt de la demande d’autorisation de ce dernier est prévue cette année. Enfin, Roche a aussi choisi d’élargir son potentiel en oncologie avec le rachat fin 2017 du californien Ignyta pour 1,7 milliard de $. L’opération lui permet d’intégrer un portefeuille alliant thérapies ciblées (inhibiteurs de tyrosine kinases, inhibiteur de la voie hedgehog…) et diagnostics compagnons capables d’agir sur différents types de cancers présentant des mutations identiques.
Roche renforce également ses activités en immunologie et développe un portefeuille d’une dizaine d’anticorps ciblant les principales pathologies autoimmunes. Le Suisse a obtenu l’autorisation en Europe et aux Etats-Unis du premier traitement indiqué dans les deux formes de sclérose en plaques, Ocrevus® (ocrelizumab). Il dispose aussi de l’étrolizumab (anticorps dirigé contre la sous-unité β7 de l’intégrine) en phase 3 dans la maladie de Crohn. Enfin, le groupe vient d’obtenir l’autorisation d’un traitement de l’hémophilie A avec inhibiteurs, Hemlibra® (emicizumab) dont les ventes sont estimées à1,635 milliard de $ en 2022. Issu de sa filiale japonaise Chugai, cet anticorps bispécifique doit aussi faire l’objet d’une demande d’enregistrement cette année pour l’hémophilie A sans inhibiteurs.
Sanofi s’étoffe en immunologie et en hémophilie
En 2017, Sanofi a poursuivi la mise en place de sa feuille de route stratégique annoncée en novembre 2015. Alors que sa division Médecine générale et marchés émergents affiche une baisse de 1%, à 14,04 milliards d’euros, Sanofi Genzyme continue à se positionner comme le principal moteur de croissance pour le groupe pharmaceutique français. Avec un résultat de 5,67 milliards d’euros, les ventes de cette division dévolue à la médecine de spécialité ont progressé de plus de 15% en 2017. Celles-ci devraient aussi profiter de l’autorisation obtenue en 2017 pour deux anticorps monoclonaux issus de sa collaboration avec Regeneron, Dupixent® (dupilumab) dans la dermatite atopique et Kevzara® (sarilumab) dans la polyarthrite rhumatoïde. Le partenariat qui l’associe à l’américain depuis 2003 devrait aussi contribuer à étoffer le portefeuille en oncologie de Sanofi, avec notamment un anticorps anti immune checkpoint inhibitor, le cemiplimab. Cet anti PD-1 est en développement pour le cancer du poumon non à petites cellules, le cancer du col de l’utérus, le carcinome basocellulaire et le carcinome épidermoïde cutané avancé, indication pour laquelle il est en cours d’évalution en Europe. Autre partenariat fructueux conclu par Sanofi, les travaux menés avec l’américain Alnylam depuis 2012 ont conduit au dépôt de la demande d’autorisation en Europe du patisiran, ARN interférent candidat au traitement de l’amylose héréditaire à transthyrétine de l’adulte.
Le groupe français vient également de se renforcer dans le domaine des anticorps pour le traitement de maladies inflammatoires avec le rachat du belge Ablynx pour 3,9 milliards d’euros et dans les maladies rares en reprenant l’américain Bioverativ pour 11,6 milliards de $ (9,47 milliards d’euros). Cette société américaine est la spin-off de l’activité hémophilie de la biotech Biogen. Créée en 2016, elle assure la commercialisation des traitements de l’hémophilie A et de l’hémophilie B, Eloctate® et Alprolix®, et développe aussi des anticorps bispécifiques et des thérapies géniques qui viendront s’ajouter au fitusiran, ARN interférent sur lequel Sanofi travaille avec Alnylam.
Dans le domaine du diabète, les ventes du groupe français ont baissé de 11,1 % à 6,39 milliards d’euros. Son insuline phare Lantus®, (insuline glargine), maintenant confrontée à la concurrence des biosimilaires, a enregistré un recul de 17,5 %, à 4,62 milliards d’euros. Lancées en 2017, sa nouvelle génération d’insuline glargine Toujeo®, et sa combinaison d’insuline glargine et de lixisénatide Suliqua® atteignent respectivement 816 millions d’euros (+27%) et 26 millions d’euros. Sanofi mise aussi sur le développement de nouveaux actifs tels que la sotaglifozine développée avec l’américain Lexicon ou l’efpéglénatide mis au point avec le coréen Hanmi Pharmaceuticals. L’agence européenne du médicament vient d’accepter le dossier de demande d’autorisation du premier pour le diabète de type 1 tandis que le second fait l’objet d’un programme de phase III dans le diabète de type 2 depuis décembre dernier. Enfin, Sanofi est aussi actif dans les biosimilaires d’insuline et a reçu en juillet dernier une AMM pour sa version biosimilaire de l’insuline lispro Humalog® pour le diabète de type 1 et de type 2. Par ailleurs, le groupe français qui a finalisé l’année dernière la reprise de l’activité Santé grand public de l’allemand Boehringer Ingelheim, mise aussi sur sa franchise vaccins et consolide cette activité en Europe après la dissolution de sa co-entreprise avec Merck&Co, Sanofi Pasteur MSD. Il renforce aussi ses capacités de production et élargit son offre de vaccins avec l’acquisition de l’américain Protein Sciences qui lui permet de disposer d’un vaccin antigrippal à base de protéines recombinantes homologué par la FDA. De plus, Sanofi collabore maintenant avec MedImmune pour développer un anticorps monoclonal destiné à la prévention des maladies associées au virus respiratoire syncytial (VRS).
Johnson&Johnson continue sa progression
7ème en 2015 derrière Gilead, 6ème en 2016 derrière Merck&Co, Johnson&Johnson progresse à nouveau d’une place pour atteindre la 5ème place du top 10. Alors que les ventes du groupe ont progressé de plus de 8 %, à 36,25 milliards de $ (32,2 milliards d’€), l’immunologie reste son aire thérapeutique majeure. Néanmoins, ses résultats n’ont progressé que de 2,3 %, à 12.24 milliards de $ (10,86 milliards d’€), en raison du recul de Remicade® (infliximab) qui subit l’impact des biosimilaires depuis 2015. Cet anticorps anti TNFα, qui a représenté 51 % des ventes de la division immunologie et 8,3 % des ventes globales du groupe, a enregistré une baisse de 9,3 % en 2017. Parallèlement, Stelara® (ustekinumab), indiqué dans la maladie de Crohn, le psoriasis et le rhumatisme psoriasique, augmente de 24 % et dépasse quatre milliards de $ de ventes en 2017. Johnson&Johnson mise également sur son nouveau traitement du psoriasis, Tremfya® (guselkumab). Les ventes de cet anticorps anti-interleukine 23 autorisé en Europe et aux Etats-Unis en 2017 pourraient atteindre 1,559 milliard de $ en 2022.
La division oncologie de J&J affiche quant à elle une santé florissante. En hausse de 25 %, à 7,25 milliards de $ (6,43 milliards d’€), ses ventes bénéficient des performances de Darzalex® (daratumumab), utilisé pour le traitement du myélome et d’Imbruvica® (ibrutinib) indiqué dans le traitement de lymphomes non hodgkiniens. Cet inhibiteur de la tyrosine de kinase commercialisé avec AbbVie a vu ses ventes progresser de 51 %, à 1,89 milliard de $ (1,67 milliards d’€). Les ventes de la division oncologie pourraient encore être gonflées dès l’année prochaine par l’arrivée de l’apalutamide dont le dossier a été déposé à la FDA en 2017 pour le cancer de la prostate. Ses ventes sont évaluées à 1,629 milliard de $ en 2022. Le groupe a aussi récolté les premiers fruits de l’acquisition d’Actelion finalisée en juin dernier. L’intégration de la biotech a ajouté une sixième aire thérapeutique au périmètre de J&J, avec une franchise hypertension artérielle pulmonaire constituée de trois produits (Opsumit®, Tracleer® et Uptravi®). Dans le domaine du VIH, des demandes d’enregistrement sont aussi en cours pour une combinaison de dolutegravir et de rilpivirine (Juluca®) en Europe et pour une combinaison darunavir/ cobicistat/ emtricitabine/tenofovir alafenamide (Symtuza®) aux Etats-Unis.
Merck&Co porté par l’immunothérapie
Rétrogradé à la 6ème place en 2017, Merck&Co a enregistré une progression de ses ventes d’1%, soutenu par les résultats de son traitement de l’hépatite C Zepatier® (ventes d’1,66 milliard de $, +199%) et par sa division oncologie avec la dynamique des ventes de Keytruda® (pembrolizumab). Initialement autorisé en 2015 pour le traitement du mélanome, son anticorps anti PD-1 est maintenant approuvé dans six autres indications (cancer gastrique exprimant le marqueur PD-L1, cancer de la vessie, cancer du poumon non à petites cellules, lymphome de Hodgkin, cancer tête et cou, cancers avec une instabilité des microsatellites ou présentant un système de réparation des mésappariements déficient). Ses ventes ont dépassé trois milliards de $, à 3,809 milliards de $ (3,37 milliards d’€, +172%) en 2017 et devraient poursuivre sur cette voie en 2018, soutenues par l’extension de ses indications. Un important programme clinique utilisant Keytruda® seul ou en combinaison est en cours dans plus d’une trentaine de types de cancers dont les cancers du sein triple négatif, le cancer de la prostate, le cancer des ovaires ou le cancer colorectal.
Par ailleurs, les résultats de Merck&Co dans le domaine des vaccins augmentent de 6%, à 6,15 milliards de $ (5,45 milliards d’€), portés à la fois par la progression de ses vaccins Gardasil® contre le papillomavirus humain et par l’intégration de ses ventes de vaccins en Europe comptabilisées auparavant au sein de sa joint-venture avec Sanofi, Sanofi Pasteur MSD, dissoute fin 2016. Enfin, plusieurs dossiers d’enregistrement sont en cours d’évaluation aux Etats-Unis, en Europe ou au Japon pour le traitement du diabète (ertuglifozine, combinaisons ertuglifozine et sitagliptine, ertuglifozine et metformine, sitagliptine et ipraglifozine) et pour le traitement du VIH (doravirine – MK-1439, combinaison doravirine/lamivudine/tenofovir disoproxil fumarate – MK-1439A).
Par ailleurs, le groupe continue à élargir sa palette dans l’immunothérapie anticancéreuse avec l’acquisition récente de deux biotech spécialistes respectivement de l’immunité innée et des virus oncolytiques. La première, l’allemande Rigontec, développe des traitements ciblant la voie de signalisation RIG-1 (retinoic acid-inducible gene I) afin d’induire une immunité antitumorale à la fois à court terme et à long terme. La seconde, l’australienne Viralytics, met au point des virus oncolytiques et un accord de recherche clinique unissait déjà les deux sociétés pour un essai combinant Keytruda® et le produit lead de Viralytics, Cavatax® dans le mélanome et les cancers du poumon, de la prostate et de la vessie.
GSK mise sur l’automédication et les vaccins
Avec des ventes en progression de 3 % en 2017, le britannique GSK est cette année le premier laboratoire du top 10 dont le chiffre d’affaires pharmaceutique est inférieur à 30 milliards d’euros. Ses ventes de médicaments de prescription ont augmenté de 7 %, à 19,71 milliards d’€ tandis que ses ventes de vaccins le positionnent parmi les leaders du secteur grâce à des ventes de 5,88 milliards d’€ (+6 %). Le groupe figure ainsi parmi les leaders pour la vaccination contre la méningite. Sa gamme de vaccins qui inclut Bexsero® et Menveo® issus de l’accord de 2015 avec le suisse Novartis, a atteint des ventes de 780 millions d’euros en 2017. Pour le futur, GSK mise aussi sur son nouveau vaccin contre le zona, Shingrix® autorisé en Europe et aux Etats-Unis en 2017. Le britannique développe également un portefeuille de vaccins contre le virus respiratoire syncytial (VRS). Par ailleurs, le groupe commence à tirer parti du renouvellement de sa gamme respiratoire où il a réalisé plus de 40 % de ses ventes (6,991 milliards de livres – 7,976 milliards d’€ /+ 3% ) en 2017. Au cœur de ses priorités, la bronchopneumopathie chronique obstructive (BPCO), maladie pour laquelle GSK a demandé en 2017 l’autorisation de son anticorps anti-interleukine 5, Nucala® (mepolizumab), déjà approuvé depuis 2015 en Europe et aux Etats-Unis pour le traitement de l’asthme sévère à éosinophiles. Deux autres candidats sont également en phase 2 dans cette indication, la danirixine (antagoniste du récepteur CXCR2) et une molécule first-in-class, le nemiralisib (inhibiteur de la PI3Kδ).
Parallèlement GSK mise aussi sur l’automédication et a décidé de racheter la participation de son partenaire Novartis dans leur joint-venture OTC (voir ci-dessus). Enfin, le groupe britannique, dont la R&D est maintenant présidée par Hal Barron, précédemment à la tête de la R&D de Calico, a choisi de recentrer les priorités de sa recherche. Ses activités se concentrent dorénavant sur quatre thématiques (maladies respiratoires, VIH, oncologie, immuno-inflammation). Dans le domaine du cancer, le groupe britannique vise en particulier le développement d’un portefeuille comprenant à la fois des petites molécules, des anticorps, des molécules multispécifiques, des adjuvants et des thérapies cellulaires utilisés seul ou en combinaison.
AbbVie continue à grimper
Entré en 10ème position du top 10 en 2015, l’américain AbbVie a encore gagné une place en 2017. Le groupe issu de la scission d’Abbott en 2013 a enregistré une progression de ses ventes de près de 10 %, à 28,2 milliards de $ (25,01 milliards d’€). Avec un chiffre d’affaires de plus de 18 milliards de $ (16 milliards d’€) en 2017, son principal produit, Humira® (adalimumab), représente 65 % des ventes. Bien que cet anticorps anti TNFα soit en passe de perdre ses brevets dans le monde, AbbVie vise toujours une poursuite de l’augmentation de ses ventes évaluées à 21 milliards de $ en 2020 (1). Parallèlement, le reste du portefeuille du groupe a généré un résultat de 9,7 milliards de $ (8,6 milliards d’€) et a bénéficié du fort accroissement des résultats d’Imbruvica® (ibrutinib). Autorisé dans cinq indications (lymphome à cellules du manteau, leucémie lymphoïde chronique, maladie de Waldenström, lymphome de la zone marginale, réaction du greffon contre l’hôte), cet inhibiteur de la tyrosine kinase de Bruton développé par Pharmacyclics a vu ses ventes progresser de 40 % et a dépassé la barre des deux milliards de $ en 2017. AbbVie table également sur Mavyret®/Maviret® (glecaprevir/pibrentasvir) qui vient d’être autorisé contre les six génotypes du virus de l’hépatite C. Le lancement de cette nouvelle combinaison d’agents antiviraux à action directe pourrait contrebalancer le recul de sa franchise VHC dont les ventes ont diminué de 16 % en 2017. De plus, le groupe américain peut aussi compter sur son portefeuille de produits en développement. Parmi les autres produits les plus avancés, on relèvera l’upadacitinib (ABT-494 – inhibiteur de JAK1) qui vient de recevoir le statut de Breakthrough Therapy pour la dermatite atopique et est actuellement en phase 3 dans la polyarthrite rhumatoïde et dans la maladie de Crohn. Dans cette dernière indication, AbbVie étudie un anticorps dirigé contre l’interleukine-23, le risankizumab, également en phase 3 pour le psoriasis. Deux nouvelles demandes d’autorisation ont aussi été déposées en 2017. La première concerne un élargissement des indications du venetoclax dans la leucémie lymphoïde chronique tandis que la seconde porte sur un antagoniste de l’hormone de libération des gonadotrophines, l’elagolix, dans l’endométriose.
Gilead : du VHC aux CAR-T
Alors que la compétition est de plus en plus forte sur un marché de l’hépatite C où une dizaine d’antiviraux ou de combinaisons d’antiviraux sont maintenant disponibles, le leader du secteur a subi un recul de ses ventes de 14 % en 2017, à 26,1 milliards de $ (23,15 milliards d’€). Le produit le plus affecté est Harvoni® (sofosbuvir et ledispavir). Ses ventes ont chuté de 52% à 4,37 milliards de $ (3,86 milliards d’€) et ne représentent plus que 19 % des résultats de la société, contre 49 % en 2015. Si le chiffre d’affaires 2018 devrait bénéficier de l’impact de l’autorisation de Sovaldi® (sofosbuvir) en Chine, Gilead a continué en parallèle à renforcer l’éventail de ses aires thérapeutiques. Après avoir choisi en 2016 d’investir dans le secteur de la stéatose hépatique non alcoolique, l’américain a frappé un grand coup en entrant de plain pied dans l’univers hyperactif et très concurrentiel des thérapies CAR-T (Chimeric Antigen Receptor T-cell – cellules T porteuses d’un récepteur chimérique). L’opération a été réalisée avec le rachat, pour 11,9 milliards de $, d’un des leaders du domaine, le californien Kite Pharma, dont le produit phare, Yescarta® (axicabtagene ciloleucel – KTE-C19) a été autorisé en octobre dernier. Cette première transaction a ensuite été consolidée par l’acquisition d’une autre biotech californienne, Cell Design Labs, afin de se doter de nouvelles plateformes pour le développement de nouvelles thérapies CAR-T.
Amgen, 1er biotech du top 10
Pour la première fois en 2017, une biotech fait son entrée dans le top 10 de l’industrie pharmaceutique. C’est dorénavant l’américain Amgen qui occupe la dixième place du classement, au détriment d’AstraZeneca qui affiche des revenus 2017 inférieurs de 384 millions de $ (340 millions d’€) à ceux du pionnier de la biotech fondé en 1980. La société active dans six aires thérapeutiques (onco-hématologie, santé osseuse, maladies cardiovasculaires, neurosciences, inflammation et néphrologie), a engrangé un revenu de 22,8 milliards de $ (20,26 milliards d’€) en 2017. Sept de ses produits (Enbrel®, Neulasta®, Aranesp®, Prolia®, Sensipar®/Mimpara®, Xgeva® et Epogen®) affichent des ventes supérieures au milliard de $. L’année écoulée a été marquée notamment par l’extension de son accord avec Novartis pour la commercialisation conjointe aux Etats-Unis d’Aimovig® (erenumab), en cours d’évaluation par la FDA pour le traitement de la migraine. Enfin, à l’instar de Pfizer, de Novartis via sa filiale Sandoz et de Merck&Co à travers son partenariat avec Samsung Bioepis, Amgen est très actif sur le front des biosimilaires. Il devrait pouvoir lancer dès cette année son biosimilaire d’Humira®, Amgevita® et a obtenu l’autorisation aux Etats-Unis de Mvasi®, biosimilaire d’Avastin® (bevacizumab). Des versions biosimilaires du cetuximab, de l’infliximab, du rituximab, de l’eculizumab et du trastuzumab sont aussi en développement en phase 3.
Le même trio de tête en 2022 ?
Alors que les estimations d’Evaluate Pharma placent Novartis, Pfizer et Roche dans un mouchoir de poche avec des ventes évaluées respectivement à 49,8 ; 49,7 et 49,6 milliards de $ en 2022, les rangs se resserrent entre les leaders de l’industrie pharmaceutique. Une nouvelle falaise de brevets se prépare avec la concurrence des biosimilaires qui arrive maintenant pour les principaux blockbusters biotech , son pic étant attendu en 2020. L’impact des biosimilaires devrait jouer un rôle majeur sur les prochains classements du top 10. Si AbbVie, Roche et Pfizer figurent parmi les plus menacés, les deux premiers disposent d’un solide portefeuille de produits en développement tandis que le n°1 du top 10 est actif sur les deux tableaux depuis son investissement dans l’acquisition d’Hospira en 2015. Après une année 2017 sous le signe des CAR-T avec l’autorisation de deux premières immunothérapies anticancéreuses basées sur ces cellules et avec l’acquisition des leaders Kite Pharma par Gilead et Juno Therapeutics par Celgene, les cartes pourraient être rapidement rebattues. L’érosion importante des ventes de sa franchise VHC pourrait conduire Gilead à sortir du top 10, tandis que Celgene pourrait y entrer sous l’effet conjugué du rachat de Juno et des ventes de son produit leader Revlimid® (lénalidomide). Ses ventes qui ont dépassé huit milliards de $ en 2017 sont estimées à plus de 14 milliards en 2022. La surprise pourrait aussi venir du pays du soleil levant avec l’arrivée d’un premier industriel japonais dans le top 10. Au cas où Takeda finaliserait l’offre de rachat envisagée sur le britannique Shire, les ventes cumulées des deux entités pourraient dépasser les 31 milliards de $ et propulser le groupe nippon dans la première moitié du classement.
Anne-Lise Berthier
Rédactrice en chef de BioPharmAnalyses
(1) Le brevet portant sur la composition d’Humira® a expiré en décembre 2016 aux Etats-Unis et arrivera à son terme dans la plupart des pays européens en octobre 2018.





COMMENTS ARE OFF THIS POST